Die Wiederbelebung von Raumtemperatur-Natriumionenbatterien
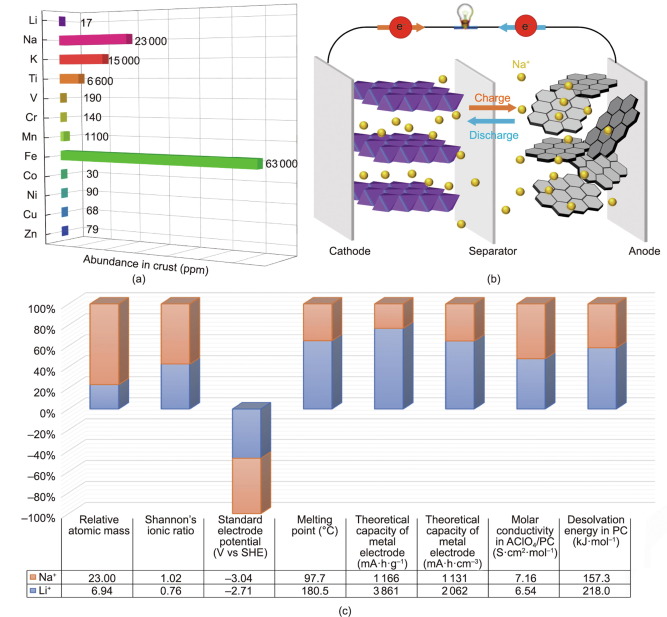
Aufgrund der reichlich vorhandenen Natriumreserven (Na) in der Erdkruste und der ähnlichen physikalisch-chemischen Eigenschaften von Natrium und Lithium ist die elektrochemische Energiespeicherung auf Natriumbasis vielversprechend für die groß angelegte Energiespeicherung und den Netzausbau. Beispielsweise haben emissionsfreie Hochtemperatur-Batterieforschungszellen auf Basis von Na/NiCl2-Systemen und Hochtemperatur-Na-S-Zellen, die erfolgreiche kommerzielle Beispiele für stationäre und mobile Anwendungen sind, bereits das Potenzial von wiederaufladbaren Batterien auf Natriumbasis demonstriert. Allerdings verursacht ihre hohe Betriebstemperatur von rund 300 °C Sicherheitsprobleme und verringert die Round-Trip-Effizienz von Natrium-Ionen-Batterien (SIBs). Raumtemperatur-SIBs (RT) gelten daher allgemein als die vielversprechendste Alternativtechnologie zu LIBs.
In der Geschichte der Batterien in den letzten 200 Jahren wurde intensiv neben der LIB-Entwicklung auch an SIBs geforscht. Die elektrochemische Aktivität von TiS2 für Lithium und seine Machbarkeit zur Energiespeicherung wurden erstmals in den 1970er Jahren vorgeschlagen. Nach dieser Entdeckung wurde Anfang der 1980er Jahre die Fähigkeit von Na-Ionen erkannt, in TiS+2 eingefügt zu werden. Mit der Entdeckung von Graphit als kostengünstigem Anodenmaterial mittlerer Kapazität für LIBs und dem Versagen, Natriumionen zu interkalieren, kam es in den 1990er Jahren zu einer raschen LIB-Entwicklung, die das Wachstum der Natriumchemie verdrängte. Dann, im Jahr 2000, erwachte das Forschungsinteresse an SIBs durch die Verfügbarkeit der Natriumspeicherung in Hartkohlenstoff (HC), die eine ähnliche Energiekapazität wie Li in Graphit liefern würde.
Ein Vergleich von Natrium-Ionen-Batterien und Lithium-Ionen-Batterien
Die Wiederbelebung von SIBs – gepaart mit dem ständig wachsenden Druck aufgrund der mangelnden Verfügbarkeit von Lithiumreserven und der damit verbundenen Kostensteigerung – bietet eine ergänzende Strategie zu LIBs. SIBs haben zunehmende Forschungsaufmerksamkeit erlangt, verbunden mit grundlegenden Errungenschaften in der Materialwissenschaft, um der zunehmenden Durchdringung erneuerbarer Energietechnologien gerecht zu werden. Die Zellkomponenten und die elektrochemischen Reaktionsmechanismen von SIBs sind grundsätzlich identisch mit denen von LIBs, mit Ausnahme des Ladungsträgers, der im einen Na und im anderen Li ist. Der Hauptgrund für die rasche Expansion der SIB-Materialchemie wird auf die Parallelen in den physikalisch-chemischen Eigenschaften der beiden Alkalimetalle zurückgeführt.
Erstens ähneln die Funktionsprinzipien und der Zellaufbau von SIBs denen kommerzieller LIBs, allerdings dient Na als Ladungsträger. Ein typisches SIB besteht aus vier Hauptkomponenten: einem Kathodenmaterial (normalerweise eine Na-haltige Verbindung); ein Anodenmaterial (das nicht unbedingt Na enthält); ein Elektrolyt (in flüssigem oder festem Zustand); und ein Trennzeichen. Während des Ladevorgangs werden Natriumionen aus den Kathoden, bei denen es sich typischerweise um geschichtete Metalloxide und polyanionische Verbindungen handelt, extrahiert und dann in die Anoden eingeführt, während der Strom über einen externen Stromkreis in die entgegengesetzte Richtung fließt. Beim Entladen verlässt Na die Anoden und kehrt in die Kathoden zurück, ein Vorgang, der als „Schaukelstuhlprinzip“ bezeichnet wird. Diese Ähnlichkeiten haben ein vorläufiges Verständnis und ein schnelles Wachstum der SIB-Technologie ermöglicht.
Darüber hinaus bringt der größere Ionenradius von Na seine eigenen Vorteile mit sich: erhöhte Flexibilität der elektrochemischen Positivität und verringerte Desolvatisierungsenergie in polaren Lösungsmitteln. Die größere Lücke im Ionenradius zwischen Li und den Übergangsmetallionen führt normalerweise zu einem Versagen der Flexibilität des Materialdesigns. Im Gegensatz dazu ermöglicht ein System auf Natriumbasis flexiblere Festkörperstrukturen als ein System auf Lithiumbasis und verfügt über eine enorme Ionenleitfähigkeit. Ein typisches Beispiel ist β-Al2O3, für das die Na-Einlagerung die perfekte Größe und hohe Leitfähigkeit aufweist. Mehrschichtige Übergangsmetalloxide mit unterschiedlichen M+x+-Stapelungsarten können in einem natriumbasierten System leicht realisiert werden. Ebenso ist die große Vielfalt an Kristallstrukturen, die für die Familie der Natriumionenleiter (NaSICON) bekannt sind, viel komplizierter als die der Lithiumanaloga. Noch wichtiger ist, dass in NaSICON-Verbindungen eine viel höhere Ionenleitfähigkeit ermöglicht werden kann, die die Ionenleitfähigkeit von Lithium-Ionenleiter-Verbindungen (LiSICON) bei weitem übersteigt.
Nicht zuletzt haben systematische Untersuchungen mit verschiedenen aprotischen polaren Lösungsmitteln gezeigt, dass der größere Ionenradius von Na eine schwächere Desolvatisierungsenergie verursacht. Das kleinere Li hat eine höhere Oberflächenladungsdichte um den Kern herum als Na, wenn beide die gleiche Wertigkeit besitzen. Li wird daher thermodynamisch stabilisiert, indem es mehr Elektronen mit den polaren Lösungsmittelmolekülen teilt. Das heißt, Li kann als eine Art Lewis-Säure klassifiziert werden. Dadurch wird für das stark polarisierte Li eine relativ hohe Desolvatisierungsenergie benötigt, was dazu führt, dass durch den Transport von Li vom flüssigen Zustand (Elektrolyt) in den festen Zustand (Elektrode) ein relativ großer Übergangswiderstand induziert wird. Da die Desolvatisierungsenergie eng mit der Übertragungskinetik an der Grenzfläche zwischen Flüssigkeit und Feststoff zusammenhängt, ist die relativ niedrige Desolvatisierungsenergie ein wesentlicher Vorteil für die Entwicklung von Hochleistungs-SIBs.